バニリン
| バニリン | |
|---|---|
 | |
 | |
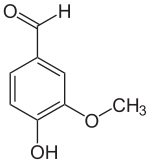
IUPAC名 4-Hydroxy-3-methoxybenzaldehyde | |
別称 メチルバニリン バニル アルデヒド | |
| 識別情報 | |
CAS登録番号 | 121-33-5 |
PubChem | 1183 |
ChemSpider | 13860434 |
UNII | CHI530446X |
KEGG | D00091 |
ChEMBL | CHEMBL13883 |
RTECS番号 | YW5775000 |
SMILES
| |
InChI
| |
| 特性 | |
化学式 | C8H8O3 |
モル質量 | 152.15 g/mol |
示性式 | C6H3(OH)(OCH3)CHO |
| 外観 | 白色あるいは淡黄色固体(通常は針状結晶) |
密度 | 1.056 g/cm³, 固体 |
融点 | 80–81 °C (353–354 K) |
沸点 | 285 °C, 558 K, 545 °F |
水への溶解度 | 1 g/100 ml (25 °C) |
| 危険性 | |
安全データシート(外部リンク) | ICSC 1740 外部MSDS |
主な危険性 | 肌、眼、気道に炎症起こす可能性 |
NFPA 704 |  1 0 |
Rフレーズ | R22, R36. |
Sフレーズ | S24/25. |
引火点 | 147°C |
| 関連する物質 | |
| 関連物質 | アポシニン、オイゲノール、アニスアルデヒド、フェノール |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
バニリン (vanillin) は、バニロイド類に属す最も単純な有機化合物であり、バニラの香りの主要な成分となっている物質である。ラテン語読みでワニリンと呼ばれることもある。
目次
1 存在
2 合成
3 用途
4 類縁体
5 その他
6 脚注
7 外部リンク
8 関連項目
存在
天然物中にはバニラ、安息香、ペルーバルサム、チョウジ(クローブ)の精油などに含有されている。収穫されたばかりのバニラ豆中には、配糖体であるグルコバニリンの形で存在しており、キュアリングと呼ばれる工程を経ることで加水分解されてバニリンが遊離し、バニラ特有の香気が発現する。バニリンの量が多いときにはバニラ豆の表面に白い結晶として析出する。1858年に、テオドール=ニコラ=ゴブリーがバニラエキスの乾燥物を熱水中再結晶してこの結晶物質を単離し[1]、バニリンの名が与えられた。
また、原料に米と黒麹を使用する蒸留酒である泡盛、奄美黒糖焼酎などは、熟成によって米由来のフェルラ酸が、蒸留中に脱炭酸されて4-ビニルグアヤコールとなり、熟成して古酒になる過程でバニリンに変化し、独特の香気を持つようになる[2]
合成
最初の合成は、1874年にヴィルヘルム・ハーマン、フェルディナント・ティーマン、カール・ライマーらにより、コニフェリンを原料として行なわれた[3]。
これによりバニリンの工業的な生産が可能となり、彼らによってそのための香料会社ハーマンアンドライマー社(現:シムライズ社)がドイツのホルツミンデンに設立された。
現在ではより効率的な4つの合成法が開発されている。サフロールバニリン、オイゲノールバニリン、グアヤコールバニリンの3つの合成法の基礎的な部分の開発を行なったのもティーマンらである。
- サフロールバニリン
サッサフラスの精油から得られるサフロールをナトリウムメトキシドで処理して二重結合を移動させると同時にアセタールを開環させ、オゾン酸化で二重結合を酸化開裂すると同時にアセタールを除去してプロトカテクアルデヒドとし、ジメチル硫酸でメチル化してバニリンとする。- オイゲノールバニリン
- クローブバニリンとも呼ばれる。チョウジの精油から得られるオイゲノールをアルカリで二重結合を移動させてイソオイゲノールとし、これをオゾンなどで二重結合を酸化開裂させてバニリンとする。
- リグニンバニリン
亜硫酸パルプの製造の際に出る廃液中のリグニンスルホン酸をアルカリ中で酸化分解してバニリンとする。リグノバニリンとも呼ばれる。- グアヤコールバニリン
- 現在主流の合成法である。グアイアコールをホルミル化して合成する。ホルミル化の方法はライマー・ティーマン反応を用いる方法やグリオキシル酸を付加させた後、これを酸化分解する方法などが知られている。
化学的合成のほかに、合成生物学を利用して細菌や藻類のDNA配列を人為的に操作することで、バニリンを生成する細菌や藻類を生み出そうという試みも行われている(シンバイオ・バニリン)。
用途
香料として使用される。食品に対してはアイスクリームをはじめとする乳製品やチョコレート、ココアなどに使用される。たばこにも使用され、ピースのバニラフレーバーは特に著名である。香水にも使用される。バニリンを香水に使用したのは、1889年にゲランより発売された Jicky が最初とされている。以降、現在までオリエンタル調の香水には欠かせない素材の1つとされている。
また、有機化学の実験室では薄層クロマトグラフィー (TLC) の発色試薬として、酸性エタノール溶液が使用されていることがある。
バニラ香料の需要はバニラ・ビーンズの生産を上回り続けており、2001年には全世界で1年間に12,000トンのバニリンが消費されたが、このうち天然のバニリンは1,800トンのみ、残りは化学合成である[4]。
類縁体
類縁体のエチルバニリン(3-エトキシ-4-ヒドロキシベンズアルデヒド)もバニリンより強いバニラ様の香りを持つ化合物として知られており、香料として用いられている。
その他
国立国際医療センター研究所に所属する山本麻由は、牛糞からバニリンを抽出することに成功し、2007年、第17回イグノーベル化学賞を受賞した。ケンブリッジ市最高のアイスクリーム店トスカニーニズ(Toscanini's Ice Cream)が彼女の成果を称えて "Yum-a-Moto Vanilla Twist" という新しいバニラアイスクリームを製作し、授賞式で振る舞われた[5]。もちろん、このアイスクリーム中のバニリンは牛糞由来ではない。
牛糞1グラムに水4ミリリットルを加えて200度で60分間加熱することで、1グラムあたり約50マイクログラムのバニリンが抽出された。つまり、牛糞中のリグニンスルホン酸をアルカリ中で酸化分解してリグノバニリンを生成したわけである。
元となった論文は、「第8回国際水熱反応ならびに第7回国際ソルボサーマル反応」合同会議で発表された「飼料中のリグニンが未消化で出ることの間接的証明」である。
人間の鼻にとって匂い始める濃度の数値は極めて微量で0.000000032 ppmであるという。
脚注
^ Gobley, N.-T. (1858年). “Recherches sur le principe odorant de la vanille”. Journal de Pharmacie et de Chimie 34: 401–405. http://books.google.com/books?id=Yrs8AAAAcAAJ&pg=PA401#v=onepage&q&f=false.
^ 照屋亮 ほか、「フェルラ酸脱炭酸能を有する新規な焼酎用酵母に関する研究」(PDF文書) - 『沖縄県工業技術センター研究報告書』第6号、2004年、那覇市、沖縄県工業技術センター
^ Tiemann, Ferd.; Wilh. Haarmann (1874年). “Ueber das Coniferin und seine Umwandlung in das aromatische Princip der Vanille”. Berichte der Deutschen Chemischen Gesellschaft 7 (1): 608–623. doi:10.1002/cber.187400701193.
^ Mark J. W. Dignuma, Josef Kerler & Rob Verpoortea (2001年). “Vanilla production: Technological, chemical, and biosynthetic aspects”. Food Reviews International 17 (2). doi:10.1081/FRI-100000269.
^ Improbable Research. “Winners of the Ig® Nobel Prize”. 2011年8月11日閲覧。
外部リンク
国際化学物質安全性カード バニリン 日本語版 - 国立医薬品食品衛生研究所 (英語版)
関連項目
- バニラ