核磁気共鳴画像法
この記事で示されている出典について、該当する記述が具体的にその文献の何ページあるいはどの章節にあるのか、特定が求められています。ご存知の方は加筆をお願いします。(2014年6月) |

頭部のMRI(T1)画像

頭の頂部から下へ向けて連続撮影し、動画化したもの
核磁気共鳴画像法(かくじききょうめいがぞうほう、英語: magnetic resonance imaging, MRI)とは、核磁気共鳴(nuclear magnetic resonance, NMR)現象を利用して生体内の内部の情報を画像にする方法である。磁気共鳴映像法とも[1]。
目次
1 概要
2 原理
3 歴史
4 画質
5 利点・欠点
5.1 利点
5.2 副作用・欠点
6 T1強調画像・T2強調画像
7 MRIを用いた一般的な画像診断学
8 核磁気共鳴画像法のいろいろ
9 心臓MRI検査
10 MR neurography
11 産業用MRI
12 出典
13 参考文献
14 関連項目
15 外部リンク
概要
被験者に高周波の磁場を与え、人体内の水素原子に共鳴現象を起こさせる際に発生する電波を受信コイルで取得し、得られた信号データを画像に構成する仕組み。水分量が多い脳や血管などの部位を診断することに長けている。MRI装置のガントリーの中にはコイルや磁石が搭載され、電流を流す原理を実現する。PET診断との組み合わせた複合タイプも一部普及しつつある。
断層画像という点では、X線CTと一見よく似た画像が得られるが、CTとは全く異なる物質の物理的性質に着目した撮像法であるゆえに、CTで得られない三次元的な情報等(最近はCTでも得られるようになってきている)が多く得られる。また、2003年にはMRIの医学におけるその重要性と応用性が認められ、"核磁気共鳴画像法に関する発見"に対して、ポール・ラウターバーとピーター・マンスフィールドにノーベル生理学・医学賞が与えられた。
原理
電子とともに原子を構成する原子核の中には、その原子核スピン(以下「核スピン」)により磁石の性質を持つものが多く存在する。しかし、(物質全体として自発的に磁化されていない限り)それぞれの核スピンの向きはばらばらであり全体でキャンセルされる結果、巨視的な磁化を発生しない。ここに外部から(強い)静磁場を作用させると、核スピンの持つ磁化は磁場をかけた向きにわずかに揃い、全体として静磁場をかけた向きに巨視的磁化ができる(以降、巨視的磁化を考える)。
この際、核スピンは静磁場方向を軸として歳差運動を発生する。歳差運動とは、コマの首振り運動と同様な運動である(回転軸と核スピンの軸が一致しない)。この運動の周波数はラーモア周波数と言われ、かけた静磁場の強さ及び磁気モーメントの強さに比例する。通常のMR撮像では、10 - 60MHzほどである。これは電磁波で言えばラジオ波の範囲にあたる。核磁化を励起するためのコイルは、RFコイルと呼ばれている。
そこに特定周波数の電磁波(ラジオ波領域)のパルスを照射すると、照射電磁波の周波数とラーモア周波数が一致した場合に共鳴が発生し、回転数が変化する(核磁気共鳴現象)。照射が終わると元の状態に戻る。重要なのは、このパルスが終わって定常状態に戻るまでの過程(緩和現象)で、それぞれの組織(通常のMRIであれば水素原子の置かれている環境)によって戻る速さが異なることである。核磁気共鳴画像法ではこの戻りかたの違いをパルスシーケンスのパラメータを工夫することにより画像化する。
しかしこのままでは、どこがどのような核磁気共鳴信号(NMR信号)を発しているのかという位置情報に欠ける。そこで静磁場とは別に、距離に比例した強度を持つ磁場(勾配磁場、または傾斜磁場)をかける。一般的に、勾配磁場を印加するコイルのことは勾配磁場コイルと呼ばれている。勾配磁場によって原子核(通常は1H)の位相や周波数が変化する。実際に観測するのは個々の信号の合成されたものであるから、得られた信号を解析する際に二次元ないし三次元のフーリエ変換を行うことで個々の位置の信号(各位置における核磁化に比例)に分解し、画像を描き出す。
医療用MRIでは、ほとんどすべての場合、水素原子1Hの信号を見ている。ところが、上記のMRIの原理を満たす原子核(核スピンが0以外)であれば、全て画像にすることが可能であり、そのような原子核は1H以外にもたくさんある。しかし、それらは1Hと比べれば極微量であり、画像にするには少なすぎる。これに対し、1Hは水を構成する原子核であるが、人間の体の2/3は水であることを考慮すると、人間の体は1Hだらけであるといえる。1Hは水以外の人体を構成する物質(たとえば脂肪)の中にも含まれている。ゆえに、1Hを画像化することは、人体(の中身)を画像にすることに近い。1H以外の原子核(炭素 (13C) 、リン (31P) 、ナトリウム (23Na) など)に関しては、研究レベルでは画像化が行われているが、臨床診断にはあまり用いられていない。
体内から発生する磁場を検出し、画像化するモダリティには他にMEGがある。ただし、MRIが上記のように外部から磁場を掛けて信号を得るのに対して、MEGは脳神経の微小電流により常時発生している微小磁場を検出するもので原理も得られる画像の質も全く異なるものである。
歴史
オランダ・フィリップス製MRI装置(3T)
(台北・三軍総医院)
1946年にFelix Bloch、Edward Purcell がNMR信号を発見[2]、1950年 電気通信大学の藤原鎮男と林昭一が日本初のNMR信号を検出した[3][4][5]。1964年にリヒャルト・R・エルンストとWeston Andersonがフーリエ変換NMRの実験に成功[6]、1960年代にソビエトのウラジスラフ・イワノフが航空機の航法装置であるプロトン磁力計の原理を元に考案して関連する複数の特許を取得したが実用化には至らず[7][8][9]、1970年にRaymond V. Damadianが腫瘍組織のT1、T2を測定した[10][11]。1973年にLauterburがMRIの提案[12]、同年、北海道大学の阿部善右衛門らによって磁場焦点法を使った生体内の局所領域のNMR信号の収集に成功[13][14][15][16]、1974年NMRによるマウス画像撮影、1978年にNMRによる初の人体画像撮影に成功した。日本では磁場焦点法を用いての画像化の試みが、田中邦雄らによって進められ[17]、1979年に動物頭部での画像化がなされた[18]。1981年に電子技術総合研究所の亀井裕孟のグループによって、200ガウス低磁場電磁石コイルにより投影画像再構成法を用いて先駆的な頭部像を撮影[19]。その後、左右大脳半球の活動の違いを検出した[20]。
医療現場に利用され始めた当初は、核磁気共鳴(NMR)現象を利用したCT(英: computer tomography、コンピュータ断層撮影)であったので、NMR-CTと言った。日本語での呼称として当初は核磁気共鳴CT検査と言っていたが、病院内で「核」という文字を使用することに抵抗があり、またMRIには放射線被曝がないという利点を誤解されかねないという懸念があり、MR-CTという呼称が考えられ、最終的には、MRIという呼称に落ちついた。日本では、東芝が国産常電導機MRI-15A(0.15T)を東芝中央病院(後の東芝病院)に設置した。また島津(SMT-20)、旭化成(MARK-J)、日立(G-10)、三洋(SNR-500)などもつぎつぎ開発され、国内外で激しく競い合う状況となる。1982年に中津川市民病院に日本国内の病院として最初に診療用に永久磁石式のFONAR QED 80-αが導入された[21][22][23]。
1983年に入ると、放射線医学総合研究所に常伝導垂直型MARK-J(0.15T)が導入され、同型機が藤元病院(現藤元総合病院)に設置された。さらに、国立大学一号機としてブルッカー社製常電導機BNT-1000J(0.15T)が東北大学抗酸菌研究所に導入された。同年5月に慈恵医大病院に厚生省から認可を受けた東芝の商用機の1号機が設置された[24]。
現在[いつ?]、超伝導電磁石を使用し強磁場を発生させることで、画像を精細かつ高コントラストで構成できるものが製品化されている。多くの施設では0.5テスラから1.5テスラの超伝導電磁石を用いたMRIが使われているが、最近[いつ?]では3テスラの超高磁場装置が日本国内でも臨床使用が認められるようになり、大規模病院を中心に普及が始まりつつある(2007年末において約100台稼働の見通し)。研究用としては、理化学研究所にバリアン製の4.0テスラの装置、国立環境研究所にバリアン製の4.7テスラの装置、新潟大学脳研究所に、人体を撮像可能なゼネラル・エレクトリック製の7テスラの装置が設置されている。
主に永久磁石を使用するオープン型MRIは、冷凍機の運転やヘリウム補充が不要などランニングコストが低いため[25]、中小規模の医療機関に広く普及している。低磁場なので騒音が少なく、漏洩磁場も少ないメリットのほか、ガントリ開口径が広いので心理的な圧迫感が少なく、外部からのアプローチも容易である。この特徴を生かし、小児や閉所恐怖症患者の検査、腰椎椎間板ヘルニアに対するレーザー治療などの術中(インターベンショナル)MRIに用いられる。
また現在[いつ?]では、リウマチやスポーツ整形等に特化した、エム・アール・テクノロジー社製[26]やエサオテ社製のコンパクト型四肢専用MRIが、日本でも販売されている。この装置は四肢撮像を対象としており、小型で、検査室の磁気シールド工事は不要である。また、閉所恐怖症や、身体の不自由な患者、他にもペースメーカー装着者など従来MRI検査が禁忌であった患者に対しても撮像が安全に施行できる可能性がある(5ガウスラインが28cm(radial)程度なため)。CTと組み合わせた「CT-MRI」や、PET(陽電子放射断層撮影)装置と組み合わせた「PET-MR」もある。
画質
基本的に濃淡を持つ白黒画像に処理・出力される。
体内の詳細を見ることができるものという一般的な概念が強いが、通常の撮影方法では256×256ピクセルであり、デジタルカメラの画素数に換算するとおよそ6.6万画素にすぎない。最近では512×512ピクセルの画像(約26万画素)を撮影できるものが普及しつつあり、1024×1024ピクセル(約105万画素)や、2048×2048ピクセル(約420万画素)の機種も出現している。
なお、MRIの本領は三次元画像にあり、さらに時間的変化まで捉えた画像も撮られているので、MRI検査におけるデータ量は、処理のためにより高性能のコンピュータの使用を要求しつつある。
利点・欠点
利点
- X線などの電離性放射線を使用しないため放射線被曝はない。
- 生体を構成する組織の種類による、画像のコントラストが、CTよりも高い。
- 造影剤を用いなくとも血管画像が撮影できる(MRアンギオグラフィー)。
- 骨によるアーティファクトが少ない。そのため骨で囲まれたトルコ鞍や脳底の病変はCTよりもMRIが描出に優れる。
軟骨や靭帯は一般的にX線CTで評価できないため、腰椎椎間板ヘルニアや靭帯損傷、肉離れ、骨軟部腫瘍、半月板損傷など、骨以外の運動器の異常の評価に有用である。
脳梗塞超急性期では拡散強調画像が有用である。X線CTより早期に病変を描出することができる。
なお横断像、冠状断、矢状断など任意の方向で撮影できることがMRIの利点であると言われてきたが、CTの撮影速度の上昇と任意断面再構成技術の発達によりこの優位性は失われた。
副作用・欠点
MRIを取り扱う上で発生しうる事故や障害の原因は患者側の要因と機器側の要因に分けられ、さらに後者は
- 強力な静磁場による力学的作用(ミサイル効果)および磁気的作用
- 傾斜磁場の変動による神経刺激
RFパルスの吸収による発熱作用- 機器の構造上発生する騒音
などに分けられる。
具体的な例を以下に列挙する。
- MRI用のガドリニウム造影剤によるアレルギー反応や嘔気の副作用がある。
- 一般的にCTと比較して検査時間が長い。そのため腹部や肺を撮影するために長時間の息止めを要し、それでもこれらの領域ではCTに対して空間解像度がやや劣る。また救急疾患では、患者が検査中に孤立するために、やや使いづらい。
- 装置が狭く、閉所恐怖症患者[27]や小児に恐怖心を抱かせることがある。オープン型MRIだと開放感があるため心的負担は軽減できる。
- 装置の発する騒音が大きい。これは傾斜磁場コイルがローレンツ力によって振動するためであり、撮影法や静磁場の大きさによっては100dBを超えるものもある。撮影シークエンスが実行されている間、検査室内にいる人は聴力保護具の着用が必要なことがあり、頭部の撮影を行う際は耳栓を、それ以外の場合はヘッドホンを装着させる。撮影する時の音が大きいため撮影に恐怖感を持つ人も居る。機器の静磁場強度が大きくなるに伴い騒音は大きくなってしまうが、固定方法の改良やメーカーによって騒音を抑える工夫がなされているため、磁場強度の増大から予想されるほどの騒音は抑えられている。オープンMRI(垂直型MRI)は構造上ローレンツ力の影響が少ないこと、使用する静磁場強度がトンネル型(平行型)MRIよりも小さいことから騒音は小さい。
- 小児では鎮静が必要となり、鎮静剤利用のリスクを考慮、検査中の合併症対応をする必要がある[28]。
- 気管支喘息の既往歴を有している場合は使用できない[27]。
- 一度磁力を落としてしまうと復旧に1~2週間必要となる。特に超伝導電磁石を利用しているものは、緊急停止などで一度電流が止まってしまうと点検後再びヘリウムを補充し、超伝導状態まで持っていくまでに長い時間がかかる。

MRI室専用酸素ボンベ
(立川・災害医療センター)
- 生体が高磁場にさらされるゆえの欠点がある。
心臓ペースメーカーやその他磁気に反応する金属が体内にあると、検査を受けられない場合がある。ただし、2012年3月に条件付きで全身MRI撮像可能なペースメーカーシステム(条件付きMRI対応承認されたペースメーカー本体とリードで構成されるシステム)が薬事承認されており、2012年10月より国内販売が開始された。現在は条件付きMRI対応機器と従来のMRI禁忌の機器が混在しているため、検査には注意が必要である。今後[いつ?]普及するものと考えられる。
人工内耳は電磁誘導により発生する誘導電流によって故障するため、2018年時点でMRI撮影に対応した人工内耳は未だ開発されていないため、撮影は禁忌である。人工内耳は強いX線によっても故障する可能性が高いためCTの撮影も受けることが出来ない可能性がある。
ヘアピン、イヤリング、指輪、入れ歯、眼鏡、磁気治療器具などの装身具・金属製品は取り外す必要がある[27]。これら金属は画像を乱し撮影に障害をきたすほか、電子機器は故障する危険がある。
人工関節、骨折部位の接合プレートやボルト、内視鏡手術によるステープラ、カテーテル手術による動脈瘤塞栓コイル、放射線治療による密封小線源や金属マーカなど、着脱不可能な体内留置金属が入っている場合は必ず医師に報告しなければならない。上記にもある通り画像を乱す。- 磁気式キャッシュカードやプリペイドカード、磁気認識方式のカードキーなどといった磁気記録メディアは間違って持ち込むと読み取り不能になることがある。
マスカラ、アイライン、アイブロウ、アイシャドー等の化粧品の中には磁性体を含む成分を含有しているものがあり、検査によって熱傷をおこすことがあるので、検査前に落とす必要がある。
カラーコンタクトレンズや入れ墨、一部の貼付薬も、上記の化粧と同様に磁性体を含んでいた場合、熱を持ち熱傷を引き起こすことがある。- 酸素ボンベや車椅子、ストレッチャー、生体モニタなどの医療器具も、MRI検査室内に持ち込むためには専用のものが必要となる。酸素ボンベをMRI室内に持ち込み、磁場で吸い付けられた酸素ボンベがMRI装置を直撃し、破壊するという事故や死亡事故が発生している[29]。
- 強磁場が人体に与える影響については、未知の部分がある[30]。そのため、妊娠中または妊娠の可能性のある場合は申し出る必要がある。
- 超伝導電磁石を使用するMRIは、冷却のための液体ヘリウムが事故によって爆発的に気化するクエンチが発生することがある[27]。
- 人体に向けて高周波のRFパルスが照射されることにより電磁波による熱力学的作用が発生する。理論上は人体組織の温度が上昇する可能性があるが、多くの施設で使用されている静磁場強度1.5T以下のMRI装置ではほとんど実感されることはない。一方で2005年に日本でも導入され、2010年代以降普及しつつある3TのMRIでは温度上昇を無視できない場合があるために、RFパルスの強さに一定の制限がかけられている。実際に人体が吸収する熱量はSAR(比吸収率、単位 W/kg{displaystyle W/kg}
)、RFパルスの強さはB1+RMS(高周波強度、単位 μT{displaystyle mu T}
)で評価され、コントロールされる。
- 脳全体を細かなボクセル単位で統計解析するには限界があり、脳細胞単位に研究できないのは世界の神経科学コミュニティにとって未だに大きな問題である[31]。
- CTとは異なる種類のアーティファクトが発生する。
- X線CTと比較すると費用が高く大掛かりな設備が必要となり、ある程度以上の規模の病院に限られてしまう。
T1強調画像・T2強調画像
緩和現象は歳差運動が元の状態に戻る過程であるが、それは磁気ベクトル方向(z方向)と回転方向(xy方向)に分けて考えることができる。z方向が熱平衡状態に戻る過程を縦緩和またはT1緩和といい、xy方向が熱平衡状態に戻る過程を横緩和またはT2緩和という。原子核では縦緩和と横緩和とが独立であることが知られており、各々別々に考える必要がある。
実際にラジオ波パルスをやめたときを時間0として、縦緩和・横緩和の磁化ベクトルの大きさを時間経過を測定すると、縦緩和は
Mz=M0(1−e−k1t){displaystyle M_{z}=M_{0}(1-e^{-k_{1}t})}
横緩和は
Mxy=M0e−k2t{displaystyle M_{xy}=M_{0}e^{-k_{2}t}}
という形に表される。
(Mz{displaystyle M_{z}}




そして、それぞれの関数の時定数 1/k1{displaystyle 1/k_{1}}



この値をそれぞれの物質による差が最も大きくなるように、パルスを与える間隔(TR、英: repetition time)と検出するまでの時間(TE、英: echo time)とを経験的に割り出し、さらにコントラストをつけるような設定を行っている。具体的にはT1強調画像ではTR=300 - 500ミリ秒、TE=10ミリ秒程度、T2強調画像ではTR=3 - 5秒、TE=80 - 100ミリ秒である。
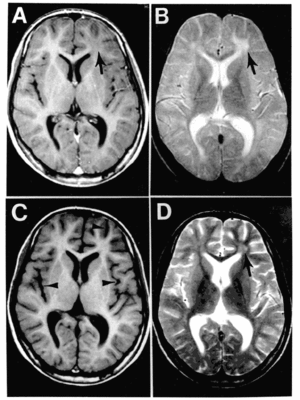
亜急性硬化性全脳炎(SSPE)のMRI像。AとCがT1強調画像で脳室内の脳脊髄液が黒く(低信号で)見えている一方で、BとDのT2強調画像では同じ脳脊髄液が白く(高信号で)見えている。
つまり、T1強調画像とはおもに縦緩和によってコントラストのついた核磁化分布を画像にしたものであり、T2強調画像とはおもに横緩和によってコントラストのついた核磁化分布を画像にしたものである。
T1強調画像で高信号、すなわち白く映し出されるものは、脂肪、亜急性期の出血、銅や鉄の沈着物、メラニンなどであり、逆に低信号(黒)のものは、水、血液などである。
T2強調画像で高信号(白)のものは、水、血液、脂肪などであり、低信号(黒)のものは、出血、石灰化、線維組織、メラニンなどである。
| T1強調画像 | T2強調画像 | |
|---|---|---|
| 低信号(黒) | 水 | デオキシヘモグロビン(急性期の出血) |
| 高信号(白) | 脂肪、メトヘモグロビン、造影剤 | 水、関節液 |
造影剤(ガドリニウム製剤)にはT1短縮作用があるため、造影剤投与後のコントラストはT1強調画像で明瞭になりやすい。このため通常の造影MRIではT1強調画像が撮像されることが多い。多くの病変ではT2強調画像で高信号となるので、T2強調画像の方が目にする機会は多いが、整形外科など脂肪を重視する科ではT1強調画像が好まれる傾向にある。T2強調画像では動脈のような早い血流では無信号、すなわち真黒にみえる。これをフローボイドという。通常動脈は真黒に見えるのだが、閉塞があると無信号とならない、これをフローボイドの消失といい、閉塞血管の所見となる。
MRIを用いた一般的な画像診断学
以下に代表的な信号パターンを示す。病態によって例外も多くある。
long T1(ロングT1)、long T2(ロングT2)パターン- T2WIにて高信号を示し、T1WIにて低信号を示すパターンである。緩和時間延長と言われることもある。一般的な病変パターンであり良性腫瘍や急性炎症で示されるパターンである。ただし嚢胞成分をもつ悪性腫瘍の嚢胞もこのような信号パターンを示すため注意が必要である。2009年現在、T2WIはFSE法(ファストスピンエコー法)で撮影された場合が多く、T2値が信号強度に最も影響される。T2値だけで考えると脳脊髄液をはじめとする液体成分が、軟骨、粘液基質が高く、特に脳脊髄液が最も純水に近く高信号を示すように思えるが、脳脊髄液よりも高信号となる病変は数多くある。内部の均一性、液面形成、FLAIR法(ふれあほう)なども用いて正常分析をするべきと考えられている。
medium T2(ミディアムT2)パターン- T2WIにて淡い高信号を示すようなパターンである。long T1、longT2パターンよりも水が多くない、あるいはT2値が長くないのが原因である。このような病変では悪性腫瘍や慢性炎症の可能性が高い。
short T1(ショートT1)パターン- T1WIにて高信号を示すパターンである。その病変のT2短縮効果によってT2WIでの信号は変化する。T2WIにて明らかな低信号を示す場合はshort T2パターンとする。このようなパターンを示すものとしては高蛋白液やムチン、メトヘモグロビンによる血腫(亜急性期出血)、一部の石灰化やT1 shortening agent(T1ショータニング・エージェント)(Gd製剤やクエン酸鉄アンモニウム)の存在があげられる。比較的特異的な病理組織上の変化を反映するため重要な所見となる。まずは脂肪、出血、高蛋白の組織を想定する。選択的脂肪抑制法を用いれば、脂肪は除外可能であり、それを用いて診断を進めていく。
short T2(ショートT2) パターン- T2WIにて低信号を示すパターンである。T1WIでの信号は病変によってことなるが、ここではT2WIにて低信号、T1WIにて高信号をしめす場合を説明する。このような信号パターンを示す病変としてはメトヘモグロビン(亜急性期血腫、short T1パターンを示す)、ヘモジデリン(陳旧性血腫)、一部の肉芽腫、メラニン色素のあるメラノーマなどがあげられる。この信号パターンを示す病変はかなり少なく、特異的な所見である。急性期や慢性期の出血が最も多い。石灰化病変はプロトンが乏しいことで short T2 パターンを示すこともある。密な石灰化はT1WIではsignal void(シグナル・ボイト)パターン(T1WIでも低信号)となるが、ある程度の石灰化では surface effect(サーフェイス・エフェクト)によりT1WIにて高信号を示しshort T2パターンとなる。また flow void(フロー・ボイド)もshort T2パターンである。flow voidとは血液や脳脊髄液の流れのために発生する信号の消失である。スピンエコー法はグラディエントエコー法に比べて原理的にflow voidを生成しやすい。MRAを行わなくても主幹動脈の閉塞はflow voidの消失を確認することで検出可能と考えられている。
signal void(シグナル・ボイド) パターン- T2WIでもT1WIでも低信号を示すパターンである。プロトン量が少ない場合が多い。このようなパターンを示す病変にはflow voidや線維性組織、ヘモジデリン(陳旧性血腫)、高濃度のT1 shortening agent(T1ショータニング・エージェント)やT2 shortening agentの存在が考えられる。
核磁気共鳴画像法のいろいろ

MRA画像
その他にも以下のような手法がある。以下、使用されているシーケンス名はメーカーによって微妙に異なることに注意が必要である。
スピンエコー法(SE)
スピンエコー法は高画質だが撮影時間が長い撮影法である。T1WIやT2WI、PDWIがこの方法で撮影される。TR、TEともに長いT2WIが最も撮影時間がかかる検査であった。TRの間に複数のエコーを取得し、時間短縮が図られたのがファストスピンエコー法(FSE)である。FSEはGEでの呼称であり、シーメンス、フィリップスではターボスピンエコー(TSE)と呼称する。さらに一つの90度パルスの後に全エコーを取得するシングルショットシーケンスもあり、シーメンスではRARE、HASTEと呼ばれている。また、T1緩和を強調するパルスを追加したのが反転回復法(IR)である。IR法の反転時間の設定を調節することで特定の信号を抑制することができSTIR法をはじめとした脂肪抑制法が誕生した。2009年現在、主流なのはFSE法とIR法を併用したfast IR法である。最近、3.0Tの機器ではRF波の人体への熱特異的吸収率(SAR)の問題があり、180度パルスを連続して使用することが困難となり、SPACEなど180度以下の再収束パルスを使うシーケンスが用いられる。
グラディエントエコー法(GRE)
グラディエントエコー法は撮影時間が短いが局所磁場の乱れに鋭敏な方法である。大きく分けると横磁化を保持するbalanced sequence(FISP, PSIF, true FISPなど)と、分断するspoiler sequence(SPFR, FLASH, turbo FLASH, VIBE, MP-RAGEなど)になる。T1緩和を強調する前パルスを付加した方法にturbo FLASH、MP-RAGE(turbo FLASHの3D版)がある。高速撮影を行い、T2/T1の良好なコントラストを得るtrue FISP(FIESTA, balanced FFE, ture SSFP)などがある。造影後のT1WIやダイナミック撮影ではほぼ必須のシーケンスであり、上腹部や乳房ではVIBEが、頭部ではMP-RAGEがよく使われている。true FISPは心臓のシネMRIや非造影冠動脈撮影(WHCMRA)で用いられる。最近[いつ?]ではmagnitude imageにphaseのコントラストを付加した磁化率強調画像(SWI)が普及しつつある。
エコープラナー法(EPI)
エコープラナー法は極めて高速に撮影できる方法でありDWIやPWIに用いられる。SE-EPIではT2コントラストの画像も高速で得られ、GRE-EPIではT2*強調画像が得られる。機能的MRI(fMRI)もこの方法である。- プロトン密度強調画像
- 縦緩和・横緩和のどちらの影響も受けにくいTR、TEで撮像したものを言う。具体的には、TRを長く(3 - 5秒)、TEを短く(10ミリ秒)設定して撮像する。T1強調画像、T2強調画像と比べ使用頻度は少ない。骨軟部の評価に有用である。
フレアー法(FLAIR:fluid attenuated inversion recovery)- 自由水の縦磁化がnull pointとなるタイミングで信号を収集し、自由水(または自由水と同程度のT1値を持つ組織)からの信号を抑制した画像を得る撮影方法。脳脊髄液に接する病変を検出しやすくする。

MELASでの拡散強調画像
拡散強調画像(DWI:diffusion weighted image)- 拡散係数が低い水を鋭敏に検出する方法である。拡散係数が低下すると高信号を示す。急性期虚血性病変や腫瘍を鋭敏に検出する。古い梗塞巣は低信号となる。特にT2WIと比較することで脳梗塞の新旧の区別が可能である。b valueといわれる変数があり、これが拡散強調の強さを示す。理想的にはb value 1000で行うとされているが周辺組織の信号低下を伴い、部位診断が難しくなる。脳においてはb value 200程度で十分とされている。細胞性浮腫(血管傷害など)、高細胞密度(悪性腫瘍)、高粘稠度(膿瘍)といった病変を検出できることからルーチンで撮影されることが多い。浮腫性病変では血管性浮腫の場合はDWIでは高信号にならないが、時間経過で細胞性浮腫の要素が出てくると高信号化する。拡散強調画像はT2強調画像を元画像としているため、T2強調画像のコントラストも反映されるため拡散低下が認められなくとも高信号を示す場合がある。
- DWIで高信号を示す場合は以下の3つの場合であることがほとんどである。ADC値が周囲より低く、元画像では周囲と同等の場合(超急性期梗塞)や、ADC値が周囲より低く、元画像でも周囲より高信号(脳梗塞急性期)、元画像で周囲より高信号でADC値が変わらない、いわゆるT2 shine throughという状態がある。ADC値を調べるために、ADC-MAPを追加することも多い。
- ADC画像
- 拡散係数をそのまま画像化したものでありADC-MAPということもある。DWIで高信号でありADC-MAPで低信号を示せば拡散係数の低下ということができる。ふたつ組み合わせることでT2 shine throughといった修飾因子を除外できる。だが、病変の検出には不向きであるため、あくまでも解釈や検討用の画像である。
- T2*強調画像
- スピンエコー法ではなくグラディエントエコー法で行われたT2WIに似たコントラストの画像である。TEが短くてもT2WIに似たコントラストが得られることからスピンエコー法が高速化される以前はT2WIの代用として用いられることもあった。2009年現在は微量な鉄の沈着の検出、特に出血性病変の検出のために用いられる。
- VSRAD
- 全脳照射法でありアルツハイマー型認知症などの診断で用いられることがある。解析には数値解析ソフトフェアMATLABやフリーソフトウェアSPMなどが用いられることがある。MPRを用いることでsagitalからcoronalへ断面を変更したり、3D再構成が可能である。
- SAS(surface anatomy scan)
- 脳表を評価する画像である。中心領から頭頂領にかけての水平断を、なるべく脳室を含まないように4cmの厚さでスキャンするという片田の方法が知られている。大脳皮質基底核変性症や神経細胞遊走障害などで用いることがある。
- CISS(Constructive Interference in Steady State image)
- 脳脊髄液を高信号、それ以外は低信号で描出するT2コントラスト画像である。頭蓋内の微細構造が描出可能であり滑車神経以外の脳神経はすべてが描出可能である。
- T2R(T2-Reversed image)
- T2コントラストを反転させた画像である。脳脊髄液を低信号、脳血管を高信号、脳実質や脳神経を中間信号として描出する。神経血管圧迫症候群の診断で用いられる。
- 脂肪抑制法
- CHESS法
- 選択的脂肪抑制法である。CHESS法で抑制されればその信号域は脂肪であるということが分かる。
STIR法(short TI inversion recovery)- 脂肪の縦磁化がnull pointとなるタイミングで信号を収集し、脂肪(または脂肪と同程度のT1値を持つ組織)からの信号を抑制した画像を得る撮影方法。眼窩内病変、脊髄病変、炎症部位を検出しやすくする方法である。非選択的脂肪抑制法であり、抑制されてもその組織が脂肪であるということはできない。
- SPAIR法
- 選択的脂肪抑制法である。CHESS法よりも磁場の不均一に強く、乳房などでは脂肪抑制の主流となっている。
- Water Excitation法(水/脂肪信号相殺法)
- 磁場の不均一に強いが、撮像時間の延長が問題となる。
灌流強調画像(perfusion weighted image)- PWIといわれる。血液量の指標となる。脳梗塞にてペナンブラの評価に用いることがある。
- single shot法
- siemens社のHASTE、GEYMSのSSFSE、PHILIPSのone shot TSE、東芝のFASEなどがsingle shot法とハーフフーリエ法を併用した方法である。MRCPやMRUで用いることが多い。撮影タイプにthin sliceとthick sliceがあり使い分けが重要となる。thin sliceではMIPなど再構成が必要となる。これらの撮影法はハーフフーリエRAREとも呼ばれる。ハーフフーリエ法を用いず通常のFourier変換を行う場合はtrue RAREと呼ばれる。
- 造影MRI
- MRIは組織特異性が高くないため、造影剤を用いることがある。
ガドリニウム化合物- ガドリニウムはその原子核的な性質上、合成スピン角運動量による磁気モーメントが最大となるため造影剤として使用される。ガドリニウム単体では毒性が強いが、ガドリニウムをキレートして安定化させた化合物を使用すれば毒性はなくなるため利用できる。細胞外液に分布して、全身の診断に用いられる。なお、ガドリニウムはカルシウムイオン濃度測定のための薬品と結合する性質があり、ガドリニウム化合物の使用後に血中カルシウムイオン濃度を測定すると実際の血中濃度よりも低い値が出てしまう。
超常磁性酸化鉄(SPIO)
肝臓を造影するための造影剤である。正常の肝臓では鉄はまずクッパー細胞でとらえられるが、異常な肝臓ではクッパー細胞が存在せず、とりこまれない。この性質を利用し、「異常な肝臓が造影されない」ということで診断的価値のある造影剤(陰性造影剤)である。- EOB・ガドリニウム造影
- マグネビストを改良し、エトキシベンジル(EOB:ethoxybenzyl)で修飾されたガドリニウム系造影剤「EOB・プリモビスト」による撮影法。エトキシベンジルにより肝細胞への取り込みが優れており、SPIOよりもダイナミックMRIでの所見がダイナミックCTに近く、肝細胞癌での撮影に近年[いつ?]多用されている[32]。
- サブトラクション画像
- 造影後の画像から造影前の画像を引き算し造影効果をわかりやすくした画像である。乳腺や大血管の評価でよく用いられる。
磁気共鳴血管画像(MRA:magnetic resonance angiography)- 狭義には管内を動くプロトン(水素原子核)のみを高信号に描出する手法で、Bright Blood Imagingとも言う。造影剤を使った方法と使わない方法がある。それに対し血管を低信号に描出し、壁の性状を評価するplaque imagingのことをDark Blood Imagingと言う。
- 非造影MRA (Bright Blood Imaging)
- 頭部においてはTOF法(time of flight)によるものが普及している。これはTRの短いグラディエントエコー法であり、MIP画像(最大値投影画像)で再構成し表示する場合が多い。腎動脈の評価ではtime SLIP法、下肢動脈ではFlesh Blood Imaging(FBI)、冠動脈ではtrue FISPを用いたwhole heart coronary MR angiography(WHCMRA)等が使われる。
- 非造影MRA(Dark Blood Imaging)
- 心電図同期でDouble Inversion Recovery法を用いたT1WI、T2WI、PDWIでプラークの性状を評価する。血液の信号をnull pointにおいたMP-RAGEを用いると、3Dでplaque imagingを撮影することができる。
- 造影MRA
- 頚部血管は内頚動脈分枝部で乱流が発生することからTOF法では評価が難しいが造影剤を用いると良好な描出が得られる。この場合の造影剤の注入にはインジェクタを用いたり、タイミング撮影を行ったりする。近年、MDCTの進歩、腎性全身硬化症(NSF)という合併症の出現などから造影MRAの使用頻度が減っている。
MR胆管膵管撮影(MRCP:Magnetic Resonance CholangioPancreatography)
胆汁・膵液が非常に長いT2値を持つことを利用し、T2強調像により、造影剤を使用せずに膵胆管像を得る方法。[33][34][35]
- MRマイクロスコピー
- 概ね100μm以下の高い空間分解能を有するMRI撮像法である。一方で、撮像範囲FOVは数mm程度しか撮影できない。
心臓MRI検査
心臓MRI検査ではシネMRI(cine MRI)による左室収縮能の評価、遅延造影MRIによる心筋梗塞や心筋線維化の評価、冠動脈MRAなどが知られている。
- cine MRI
- 心電図同期を利用して心臓の動きを1心拍16〜40コマの動画として撮影する方法である。SSFP法(ステディー・ステート・フリープリセッション法)では造影剤を用いないでも高い血液信号が得られる。2010年現在、最も正確な心機能測定法とされている。心基部から心尖部まで連続した短軸シネMRIを撮影しシンプソン法を用いて左室容積、左室駆出率や左室重量を計測する。
- 遅延増強効果
- Gd造影剤を静注して約10分後撮影する方法を遅延造影MRIという。正常心筋が低信号を示すが梗塞心筋や線維化が認められた場合は高信号を示す。糖尿病患者の無症候性心筋梗塞など心臓超音波検査でも検出ができない病変の検出も可能である。
- 冠動脈MRA(whole heart coronary MRA)
- 16列マルチスライスCTとほぼ同等の検出率を示すと言われ撮影時間が10分以上と長い。64列マルチスライスCTと比較すると診断感度がやや劣るとされているが、NPV(negative predictive value=病気がなく正常である)が高いために病気がないことを証明するには非常に有効である。CTは簡便で早く検査ができるが、冠動脈MRAは放射線被ばくや造影剤が不要なため、繰り返し検査が必要となる先天性疾患(川崎病など)のフォローアップに非常に有用であり、一般成人に対しては「突然死を防ぐスクリーニング」として、その有用性が期待されている。
MR neurography
3テスラのMRIを用いたMR neurography(MRN)が様々な末梢神経障害に応用されている[36][37]。MRNの神経描出の原理は神経周膜内部の水がT2WIおよびSTIRで高信号を示すことによる。STIR冠状断を用いて腕神経叢を評価し、MIP法で再構成する。読影には健側と患側を比較する。下記の末梢神経障害での所見が知られている。
| 疾患 | 臨床像 | MRI/MRN所見 |
|---|---|---|
| 神経痛性筋萎縮症 | 一側の上肢の急性の神経痛とこれに続く筋萎縮 | 腕神経叢の浮腫性変化、偽陰性の報告あり |
| 頚椎症性神経障害 | 一側の上肢の急性の神経痛とこれに続く筋萎縮 | 障害された神経根に合致した浮腫性変化、腕神経叢はびまん性の異常を示すこともある |
| 神経原性胸郭出口症候群 | 神経痛性筋委縮症様の神経痛が認められない。母指球萎縮、小指しびれ感 | 神経の上方に凸の偏位、斜角筋異常、索状構造の描出 |
| 術後腕神経叢障害 | 手術体位(上肢過外転)、可逆性の障害が多い | 浮腫性変化 |
| 放射線照射後 | 悪性腫瘍に類似するが、疼痛は軽度のことが多い、ミオキミアあり | びまん性の腫脹 |
| CIDP | 神経痛性筋委縮症様の神経痛が認められない。両側性で、亜急性から慢性に進行する。 | 神経の高度かつびまん性の肥厚 |
産業用MRI
カリフォルニア大学デービス校ではワイン開封せずMRIで調べる研究をしている[38]。食品の品質管理のために小型のMRIが開発されている[39][40]。
出典
^ “とっさの日本語便利帳の解説”. コトバンク. 2018年2月12日閲覧。
^ MRI開発史と科学者たち
^ 我が国初のNMR分光器
^ 我が国最古の高分解能NMRの磁石(MRIのルーツ)
^ 『電通大学報』第3巻、電気通信大学。
^ Ernst, R. R.; Anderson, W. A. (1966年). “Application of Fourier transfom spectroscopy to magnetic resonance”. Rev. Sci. Instrum 37: 93-102.
^ Russian claims first in magnetic imaging
^ ПРИВЕТ НОБЕЛЮ ОТ ИВАНОВА
^ Patents by Ivan Vladislav
^ Damadian, R. (1971年). “Tumor detection by nuclear magnetic resonance.”. Science 171: 1151-1153.
^ アメリカ合衆国特許第3,789,832号
^ NMR/MRIの歴史
^ 阿部善右衛門、田中邦雄、堀田正生「核磁気共鳴現象を利用した体外よりの生体計測の研究」、『計測自動制御学会論文集』第10巻第3号、1974年6月、 290-297頁。
^ 田中邦雄、佐野文男、阿部善右衛門「核磁気共鳴現象による無侵襲生体計測法の研究」、『医用電子と生体工学』第12巻第2号、1974年、 81-89頁。
^ アメリカ合衆国特許第3,932,805号
^ 1973:北大 阿部らによる磁場焦点法を使ったNMRイメージングの研究
^ 田中邦雄、清水哲也、山田芳文「磁場焦点法による核磁気緩和時間の無侵襲測定とそのイメージング」、『電子通信学会医用電子・生体工研資』第79巻第67号、電子通信学会、1979年、 1-7頁。
^ 山田芳文「磁場焦点法によるNMRイメージング」、『NMR医学』第1巻、1981年、 54‐61。
^ 亀井裕孟、片山義朗「人体頭部用NMR断層映像装置」、『NMR医学』1981年、 45-49頁。
^ Kamei H、Katayama Y、Yokoyama H「A noninvasive method to detect the difference in functions of cerebral hemispheres by 'differentia1' NMR、In:Microcirculation An Update」、『Excerpta Medica』第1巻、Amsterdam-New York-Oxford、1987年、 417-420頁。
^ 古瀬 和寛「磁気共鳴診断装置FONAR QED 80ーaIpha導入の思い出」、『MEDICA1 IMAGING TECHNOLOGY』第17巻第3号、1999年5月。
^ 古瀬 和寛「地域医療における画像診断の役割と展開とくに磁気共鳴診断装置登場の背景とその後の歩み」、『全国自治体病院協議会雑誌』第373号、全国自治体病院協議会、1999年7月、 35-49頁。
^ 井澤 章「2001年号記念企画 1号機物語・MRI編 FONAR QED80α導入の想い出」、『日本放射線技術学会雑誌』第57巻第3号、2001年3月、 302-307頁。
^ 日本初のMRI装置
^ 「核磁気共鴫現象による生体計測のための基礎的検討」、『北海道大学電子科学研究所技術部技術研究報告集,』1992年、 52-57頁。
^ 筑波大学発,関節リウマチ診断用コンパクトMRIが薬事認証を取得
- ^ abcd宮地利明、MRIの安全性(<シリーズ>MR) 日本放射線技術学会雑誌 2003年 59巻 12号 p.1508-1516, doi:10.6009/jjrt.KJ00000921680
^ MRI検査時の鎮静に関する共同提言 (PDF) 日本小児科学会・日本小児麻酔学会・日本小児放射線学会(2013年5月26日)
^ CHALJUB G. Projectile cylinder accidents resulting from the presence of ferromagnetic nitrous oxide or oxygen tanks in the MR suite. Am J Roentgenol. (2001) vol.177, no.1, p.27-30., doi:10.2214/ajr.177.1.1770027
^ Electromagnetic fields and public health---Static electric and magnetic fields. WHO fact sheet N299 March 2006
^ The New Yorker『Neuroscience Fiction』、2012年11月30日
^
バイエル薬品株式会社 (2008年1月25日). “バイエル薬品: EOB・プリモビスト注シリンジ 新発売”. 2015年9月16日閲覧。
^
[仙台星陵クリニック] (2000年5月). “星陵CL画像ニュース平成12年5月号「MRCP(MR胆管膵管撮影)」 (pdf)”. 2015年9月16日閲覧。
^
長野 章「腹部領域におけるMRI撮像(胆道・膵臓系)」 (pdf) 、『アールティ』第5号、エーザイ株式会社、2001年1月、 9-12頁、2015年9月16日閲覧。
^
蒲田 敏文、鹿沼 成美「胆道癌における画像診断の最前線:MDCT,MRIを中心に」 (pdf) 、『胆道』第27巻第1号、2013年、 81-91頁、2015年9月16日閲覧。
^ 脊椎脊髄ジャーナル 29巻9号
^ 脊椎脊髄ジャーナル 31巻5号
^ Wine Tech
^ 食品品質管理用コンパクトMRI装置の開発
^ 産業用MRIの開発
参考文献
- MRI自由自在 ISBN 9784895537711
- 腹部のMRI 第2版 ISBN 9784895925549
- 脳脊髄のMRI 第2版 ISBN 9784895925990
- I.L.ピケット「医療用NMRスキャナー」、『サイエンス』1982年7月号、 20頁。
Ian L.Pykett (1982年5月号). “NMR Imaging in Medicine”. サイエンティフィック・アメリカン 246 (5): 78-88. http://www.fis.cinvestav.mx/~lmontano/sciam/NMR-scam0582-78-91.pdf.
- 巨瀬勝美 『NMRイメージング』 共立出版、2004年5月15日。ISBN 9784320043626。
- 巨瀬勝美 『コンパクトMRI』 共立出版、2004年11月15日。ISBN 9784320043749。
- 半田晋也、拝師智之、巨瀬勝美「MRI装置のしくみとそのRF技術」、『RFワールド』第4巻、CQ出版、2008年12月1日、 78-87頁、 ISBN 9784789848978。
関連項目
- DICOM
- 医用画像処理
- T1強調画像
- T2強調画像
- 磁気共鳴血管画像
- 核磁気共鳴分光法
- OsiriX
レイモンド・ダマディアン、ポール・ラウターバー、ピーター・マンスフィールド
外部リンク
- 遠隔読影・遠隔画像診断UP TO DATE
- GEヘルスケア
- シーメンス・ジャパン
- フィリップスエレクトロニクスジャパン
- 東芝メディカルシステムズ
- 日立製作所 ヘルスケア
- マスタック(エサオテ社MRI装置の日本国内販売元)

