ヘリウム
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外見 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 無色の気体 高電圧をかけると紫色に発光  ヘリウムのスペクトル | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 一般特性 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
名称, 記号, 番号 | ヘリウム, He, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
分類 | 希ガス | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
族, 周期, ブロック | 18, 1, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
原子量 | 4.002602(2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
電子配置 | 1s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
電子殻 | 2(画像) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理特性 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
相 | 気体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
密度 | (0 °C, 101.325 kPa) 0.1786 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
融点での液体密度 | 0.145 g/cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
融点 | (at 2.5 MPa) 0.95 K, −272.20 °C, −457.96 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
沸点 | 4.22 K, −268.93 °C, −452.07 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
臨界点 | 5.19 K, 0.227 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
融解熱 | 0.0138 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸発熱 | 0.0829 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
熱容量 | (25 °C) 20.786 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸気圧(defined by ITS-90) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子特性 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
イオン化エネルギー | 第1: 2372.3 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 第2: 5250.5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
共有結合半径 | 28 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ファンデルワールス半径 | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| その他 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
結晶構造 | 六方晶系 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
磁性 | 反磁性[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
熱伝導率 | (300 K) 0.1513 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
音の伝わる速さ | 972 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
CAS登録番号 | 7440-59-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 主な同位体 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細はヘリウムの同位体を参照 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ヘリウム (新ラテン語[2]: helium, 英: helium [ˈhiːliəm])は、原子番号 2、原子量 4.00260、元素記号 He の元素である。
無色、無臭、無味、無毒(酸欠を除く)で最も軽い希ガス元素である。すべての元素の中で最も沸点が低く、加圧下でしか固体にならない。ヘリウムは不活性の単原子ガスとして存在する。また、存在量は水素に次いで宇宙で2番目に多い。ヘリウムは地球の大気の 0.0005 % を占め、鉱物やミネラルウォーターの中にも溶け込んでいる。天然ガスと共に豊富に産出し、気球や小型飛行船の浮揚ガスとして用いられたり、液体ヘリウムを超伝導用の低温素材としたり、大深度へ潜る際の呼吸ガスとして用いられている。
目次
1 特徴
2 用途
3 歴史
3.1 発見
3.2 産出と利用
4 同位体
5 脚注
5.1 注釈
5.2 出典
6 関連項目
7 外部リンク
特徴
標準状態において、ヘリウムは単原子ガスとして存在する。ヘリウムを固化するには非常に特殊な条件下に置かなければならない。元素の中で沸点が最も低く、標準圧力下では温度を下げて絶対零度になっても不確定性原理のため液体のままであり、固化するにはさらに高い圧力をかける必要がある。臨界温度は 5.19 K と非常に低い。固体ヘリウムはヘリウム3とヘリウム4で必要な圧力が異なり、圧力を調節して体積の 30 % をコントロールすることができる。ヘリウムは比熱容量が非常に高く、密度の高い蒸気となり、部屋の温度が上昇すると素早く膨張する。
固体ヘリウムは 1.5 K、2.5 から 3.5 MPa という非常に低い温度と高い圧力の下でしか存在できない。だいたいこのくらいの温度以上になると、相転移を起こしてしまう。これ以下の温度ではそれぞれ立方体型の分子を作っている。
ヘリウム4の2つの液体状態、ヘリウムIとヘリウムIIは、量子力学の研究(超流動現象)において重要で、物質が超伝導を帯びるような絶対零度に近い超低温で発現する。
用途
以下に挙げるような様々な用途に使用されている[3]。
- ヘリウムガス
- ヘリウムは水素の 92.64 % もの浮揚力があり、燃えないため、水素よりも安全なガスとして風船等の浮揚用ガスとして利用され、広告用バルーンや天体観測用気球、軍事用偵察気球などに使用されている。また、ヘリウム中では音速が空気中よりずっと速い(純粋ヘリウム中では約 1000 m/s)ため[注 1]、ヘリウムを吸入してから発声すると、甲高い音色の奇妙な声が出る(ドナルドダック効果)。これに着目して、いわゆるパーティグッズとしても利用される。このような市販の「変声」用ガスには、酸欠等になるのを防ぐために酸素が 20 % ほど含まれているが、風船用ガスとの誤用による事故[4]や吸い過ぎによって嘔吐や意識を失う事故が度々発生[4][注 2]しており、その大半は12歳以下の子供によるものである[5]。ヘリウムに薬理作用はないが、酸素を混合していないガスの吸引による自殺に使用された例も報告されている[6]。
- 低温工学
- ヘリウムは沸点、融点ともに最も低い元素であり、液体ヘリウムは他の超低温物質よりも低温となり、超伝導や低温学など、絶対零度に近い環境での研究が必要な分野で冷媒として使用されている。また、ヘリウム3とヘリウム4を使った希釈冷凍法がある。
- 労働産業
- ヘリウムと酸素等との混合ガスはテクニカルダイビングなど、大深度潜水用の呼吸ガスとして用いられる[7][8]。ヘリウムは窒素よりも麻酔作用が少ないため、窒素中毒などの中毒症状を起こしにくい。さらにヘリウムは粘度が低いため、高圧下でも呼吸抵抗が小さく、身体からの排泄速度が速い[9]とされている。しかし、特定の条件下では気泡が生じやすく一旦血管内に気泡が生じた場合は消失しにくいとの報告がある[10]。欠点として熱伝導率が高いため、体温調節が難しくなり低体温症になる危険がある[11]こと、また空気と比較してはるかに高価であることがある。ヘリウムと酸素の混合ガスであるヘリオックスと、ヘリウム、酸素、窒素を混合したトライミックスがある。
- 医療
- また液体に溶けやすく人体に無害と言う特性もあり、血管内で素早く膨らませたり縮めたりすることで心臓の機能を補助する IABP のバルーンに吹き込む気体として採用されている。
- 液体ヘリウムは NMR や MRI の測定装置で超伝導電磁石の冷却に使われている。
- その他
能美防災の民生用蓄圧式消火器には、窒素の代わりに圧力源として使われている。
ガスクロマトグラフィーなどのキャリヤーガスとしても使用される。- 液体ヘリウムはロケットの噴射口を守る冷却剤、シリコンやゲルマニウム結晶の保護材、あるいは原子炉の冷却材、超音速風洞実験での充満ガス、タンデム加速器の超伝導ブースター[12]などに用いられている。
- ヘリウムの同位体の一つであるヘリウム3は核融合発電の燃料としての利用が考えられている。しかし、現在熱核融合炉で想定されている温度の領域では、トリチウム燃料の場合に比べて核融合反応が起こりにくい上、地球上で天然に採取する事はほとんど不可能である。太陽から噴出した太陽風が月面に堆積した物を採取する、木星などの木星型惑星で採取する等の方法が検討されている[要出典]。
- ヘリウムは分子が小さく、きわめて微小な孔にも浸入可能であるため(ヘリウムを詰めた風船が時間が経つと小さくしぼみ、浮力が落ちるのはこのためである)、配管のリーク(漏れ)を高精度で非破壊検査するのに用いられることがある(配管に気体のヘリウムを流してヘリウムリークディテクタで漏れを検知する)。前述の特徴のほか、化学的に安定で人畜に無害、また大気中にほとんど存在しないため誤検出の心配がないなど、この用途には理想的な物質であるとされている。しかしわずかな隙間にも侵入するため、潜水艦や減圧室などヘリウムの混合ガスを使用する状態において、防水として設計された時計などの隙間にも侵入し、圧力変化によって腕時計のガラスを吹き飛ばしてしまうことがある。このため、一部のダイバーズ・ウォッチにはヘリウム・エスケープ・バルブが付いており、この機構で内部のヘリウムを自動的に外へ逃がすことができる。水素に次いで軽い気体であるため、ポンプなどを使って移動させる時に少ないエネルギーで素早く移動させる事ができる。
歴史
発見
ヘリウム原子の存在を示す最初の証拠は、1868年8月18日に太陽の彩層部分を分光スペクトル観測した際の波長587.49ナノメートルの黄色い輝線だった。これを発見したのは、インドのグントゥールで皆既日食を観察していたフランス人天文学者のピエール・ジャンサンだった[13]。彼は当初、この線はナトリウムを示すと考えたが、同年10月20日にイギリス人天文学者ノーマン・ロッキャーがやはり太陽光を分析して黄線を観測し、ナトリウムのフラウンホーファー線記号 D1や D2 に近かったことから、D3 と名づけた[14]。ロッキャーは、この元素が太陽を構成する地球では知られていない元素だと結論づけ、彼とイギリスの化学者エドワード・フランクランドは、ギリシア語で太陽 (ἥλιος) を意味する「ヘリウム」と名づけた[15][16][17]。
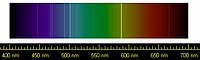
ヘリウムのスペクトル
1882年、イタリアの物理学者ルイージ・パルミエーリは、ヴェスヴィオ山の溶岩を分析していた際に、スペクトル D3 線を見つけた。これが地球上で初めてヘリウムの存在を示唆する証拠となった[18]。
1895年3月26日、イギリスの化学者ウィリアム・ラムゼー卿がクレーベ石(10 % 以上の希土類元素を含む閃ウラン鉱)と無機酸を反応させる実験を通じてヘリウムの分離に成功し、地球上で初めて生成した。ラムゼーはアルゴンを探していたが、硫酸で発生させたガスから窒素や酸素を取り除いた残りをスペクトル分光して調べたところ、太陽光と同じ D3 線を発見した[14][19][20][21]。そしてこれが、ロッキャーやウィリアム・クルックスが名づけた「ヘリウム」であると同定した。実はアメリカの地球科学者ウィリアム・フランシス・ヒレブランドがラムゼーに先立ち閃ウラン鉱標本の試験を行っている際に変わったスペクトルを見つけていたが、彼はこれを窒素のスペクトルと思い込んでいた。ヒレブランドはラムゼーに祝辞の手紙を送っている[22]。
原子量を計測できる程度の量は、スウェーデンウプサラ市でペール・テオドール・クレーベとアブラハム・ラングレが抽出に成功した[23][24]。
1907年(1903年?)にアーネスト・ラザフォードとトーマス・ロイズは、新しく見つかったガスをガラス管に詰めてスペクトルを調べようとした際に、粒子が薄いガラス壁を通り抜けることを見つけ、アルファ粒子がヘリウムの原子核であることを突き止めた。1908年にはオランダのヘイケ・カメルリング・オネスがガスを 1 K 以下まで冷却し、液化に初めて成功した[25]。彼はさらに温度を下げて固体を得ようとしたが、常圧のヘリウムは三重点を持たないため、これには失敗した。しかし、1926年に、オネスの教えを受けたウィレム・ヘンドリック・ケーソンが 1 cm3 のヘリウム固体化に初めて成功した[26]。
1938年、ロシアのピョートル・カピッツァは絶対零度近くまで冷却したヘリウム4がほとんど粘性を持っていないことを発見し、これは超流動と呼ばれた[27]。1972年には、アメリカのダグラス・D・オシェロフ、デビッド・リー、ロバート・リチャードソンによって、絶対零度に近い温度域でヘリウム3でも同じ現象が発見された[28]。
産出と利用
1903年、アメリカ・カンザス州デクスターで石油掘削のボーリングが行われたところ、不燃性のガスが湧き出た。カンザス在住の地質学者エラスムス・ハワースがこれを収集し、ローレンス市のカンザス大学で化学者ハミルトン・キャディとデイヴィッド・マクファーランドの協力を得て成分解析を行った。その結果、ガスは質量比で窒素 72 %、メタン 15 %(酸素がなかったため燃焼しなかった)、水素 1 % と、残り 12 % の成分は解明できなかった[29]。さらに解析を進めた結果キャディとマクファーランドは、1.84 % はヘリウムであることを突き止めた[30][31]。これによって、地球全体では希少であるヘリウムがアメリカのグレートプレーンズ地下に大量に存在しており、天然ガスの副産物として入手可能だということが判明した[32]。
ただし化石燃料とは生成の経緯が異なり、長い年月をかけてウランとトリウムが放射性崩壊することによりヘリウムができる。アメリカの主なヘリウム含有ガス田は、ほとんどがカンザス州、オクラホマ州、テキサス州西部の地域にある[33]。
この発見によって、アメリカ合衆国は一大ヘリウム供給国となった。第一次世界大戦時、リチャード・スレルホール卿の助言を受けて、アメリカ海軍は3基の実験的な小規模ヘリウム製造設備に投資をした。これは、空気よりも軽く不燃性のガスを阻塞気球に使う目的があった。これ以前、ヘリウムガスは通算で 1 m3も得られていなかったのだが、この計画で生産されたガスは純度 92 % で 5,700 m3 にのぼり[14]、1921年12月1日に処女航行を行った世界初のヘリウム飛行船 C-7(アメリカ海軍)にも使われた[34]。

ヘリウムモニュメント。1968年、ヘリウム発見100周年を記念してテキサス州アマリロに造られた。
第一次世界大戦中、抽出方法は低温によるガスの液化法からそれほど改良されなかったが、生産は続けられた。当初は飛行船などの浮揚ガス需要が中心だったが、第二次世界大戦中にはそれに加えアーク溶接用の需要が拡大した。ヘリウム質量分析計も原子爆弾を製造するマンハッタン計画で用いられた[35]。
1925年、テキサス州アマリロでアメリカ合衆国連邦政府は「ヘリウム国家備蓄」を開始した。これは、民間の商用や戦時の軍用目的の飛行船へ供給体制を備えることを目的とした「連邦によるヘリウムの国家戦略的備蓄」である[14]。アメリカ軍はドイツへのヘリウム輸出を制限したが、これが水素を用いざるをえなくなったヒンデンブルク号の爆発事故の遠因となった。大戦後にヘリウム需要は縮小したが、1950年代に入ると、宇宙開発競争や冷戦を背景としたロケットエンジンの推進剤用などへ酸素や水素の冷却用として、ヘリウムの用途は広がった。1965年、アメリカのヘリウム消費量は戦時中の最大量の8倍にもなった[36]。「ヘリウム条例1960修正条項」 (Public Law 86–777) 発布後、アメリカ合衆国鉱山局 (USBM) は、カンザス州ブシュトン市にある複数の民間所有ガス精製工場から天然ガス中のヘリウム回収を始め、これを延長 684 km のパイプラインでテキサス州アマリロ近郊のクリフサイドにある国家備蓄基地へ集約した[33]。これらのヘリウム-窒素混合ガスはクリフサイド周辺のガス田に再注入され、純度向上と貯蔵を両立させた[37]。
1995年段階で、アメリカのヘリウム備蓄量は 10億 m3[33](14億ドル相当)に達し、翌年に議会は貯蔵増の停止と[38]、「ヘリウム民営化条例1996」(Public Law 104–273) を採決して、2005年までに備蓄ヘリウムをすべて販売することを内務省に命じた[33][39]。ただし、備蓄分の売り切りは2015年と予想される[33]。
1930年から1945年にかけて生産され、飛行船に使われたヘリウムの純度は 98.3 % であった。1945年には純度 99.9 % ヘリウムが溶接用に少々製造された。1949年までにヘリウムはグレードA (99.95 %) まで商用生産が実現した[40]。

工業用ヘリウムの需要は急増している。
長い間、アメリカは全世界の商用ヘリウム生産量 90 % 以上を担ってきた。その他にはカナダ、ポーランド、ロシア等でも生産された。1990年代中頃、アルジェリアのアルゼウにて、全ヨーロッパの需要量を賄う 1,700万 m3 の新工場が稼動を開始した。2000年までにアメリカのヘリウム総需要は年間 1500万 kg まで増加したが[41]、2004年から2006年にかけてカタールのラス・ラファンとアルジェリアのスキクダでそれぞれ新工場の建設が行われた。2007年段階で、ラス・ラファンは稼動率 50 %、スキクダは未稼働の状態にある。しかし、アルジェリアはスキクダでの生産が始まれば、世界2位の供給国となる[42]。その一方で、世界的なヘリウム需要は価格とともに上昇し[43]、2007年の消費量は2002年比倍増となった[44]。需給バランスの変動により、将来は深刻なヘリウム不足と価格高騰が予測される[45][46]。
2012年には、世界的なヘリウム供給不足が発生した。原因は、アメリカでの設備トラブル、新興国での需要増などが考えられている[47][48]。このため、東京ディズニーリゾートでは2012年11月21日からパーク内でのヘリウム風船の販売を休止した[49]。
2013年12月、カタールのラスガスが世界最大級の年産3,680万立方メートルの生産設備を稼動させた[50]。
日本は全量を輸入に頼っているが、財務省の貿易統計では近年の日本の輸入量は年間2,000トン前後。2012年、2013年にはアメリカの生産減で品不足となったが、これを補うためにカタールほかからの輸入が増えている。2013年は全輸入量1,902トン中、米国からが1,747トン (シェア 91.8 %)、カタールからが121トン (6.4 %)、その他からが34トン (2.8 %) であったが、2014年に入りカタールのシェアが急増している[51]。
2016年 タンザニアで大規模なヘリウムガス田が発見されたと報道された[52][53]。

国際海上での『 ヘリウムガス 』輸送用に、『 ユニオンヘリウム 』が所有している40ft型、タンクコンテナ。
※コンテナ個々のコンテナ#構造区分コード不明。
【 兵庫県/神戸ポートアイランドにて 】

国際海上での『 ヘリウム 』輸送用に、アメリカ 『 LINDE LLC 』 が所有している40ft型、タンクコンテナ。
※コンテナ個々の構造区分コード ( 42TG ) 使用。
【 兵庫県/神戸ポート・アイランドにて 】

国際海上での『 ヘリウムガス 』輸送用に、『 日本エア・リキード 』が所有している40ft型、タンクコンテナ。
※コンテナタイプコード ( FXX 4278 ) 使用。
【 兵庫県/神戸ポートアイランドにて 】

国際海上での『 ヘリウムガス 』輸送用に、『 太陽日酸 』が所有している40ft型、タンクコンテナ。
※コンテナ個々の構造区分コード不明。
【 東京都/大井埠頭にて 】
同位体
天然に存在するヘリウムの同位体には、陽子2つと中性子1つからなるヘリウム3と、陽子2つと中性子2つからなるヘリウム4の2種類がある。ヘリウム3は、地球の大気中においてはヘリウム4に対して100万分の1の量しか存在しないため[54]、原子炉で生成されたものが利用される。原子炉内でリチウム6に中性子を照射すると三重水素とヘリウム4ができ、この三重水素がベータ崩壊(半減期12.5年)してヘリウム3となる。そのほか、人工的に作られた同位体としては、ヘリウム6、ヘリウム8、ヘリウム10などがある。
ヘリウムの同位体を用いた地球化学的な応用は大きく分けて2つある。まず、ヘリウム3をトレーサーとして用い、地球物質の循環を探ることである。もうひとつは岩石中に天然に存在する放射性同位体であるウランやトリウムのアルファ崩壊に伴って放出されるヘリウム4の蓄積量から、その岩石の生成年代を求めること(U, Th/He 放射年代測定)である。
脚注
注釈
^ 共鳴の起こる波長(喉頭腔の大きさに依存)を一定とすると、周波数はその媒質を伝わる波の速さに比例する。周波数#定義を参照。
^ 2015年1月には12歳の児童がテレビ番組の収録中にこのガスを一気に吸引したことによって意識不明となり、このようなケースでは日本で初めて「脳空気塞栓症」と診断された事故が起きている(後に回復した)。テレビ朝日#不祥事・事件・トラブル、児童労働#児童労働の例、3B juniorの星くず商事も参照されたい。
出典
^ Magnetic susceptibility of the elements and inorganic compounds (PDF) (2004年3月24日時点のアーカイブ), in Handbook of Chemistry and Physics 81st edition, CRC press.
^ WEBSTER'S DICTIONARY, 1913
^ 牧村博之、山本澈誠、希ガスの取り扱い 分析化学 Vol.21 (1972) No.11 P1540-1551, doi:10.2116/bunsekikagaku.21.1540
- ^ ab12歳アイドル、テレ朝収録中に倒れ搬送(2015年2月8日時点のアーカイブ) 日刊スポーツ芸能ニュース - 朝日新聞デジタル&M 2015年2月5日
^ ヘリウム事故、注意呼びかけ…12歳以下に集中(2015年2月8日時点のアーカイブ) 読売新聞(YOMIURI ONLINE) 2015年2月6日
^ 乗峯絵理、宮田勝文、石澤不二雄 ほか、血中ヘリウムの分析 日本法科学技術学会誌 Vol.18 (2013) No.1 p.65-70, doi:10.3408/jafst.18.65
^ 海洋科学技術研修テキスト 飽和潜水 日本財団図書館(電子図書館)
^ リウム混合ガス深々度短時間潜水減圧法の開発と大深度潜函作業減圧法への応用 人間工学 Vol.29 (1993) No.Supplement P156-157
^ 檜木暢雄, G.IMBERT, M.HUG0N、高圧ヘリウム・酸素環境に於ける呼吸放熱 The Annals of physiological anthropology Vol.3 (1984) No.3 P227-236, doi:10.2114/ahs1983.3.227
^ 野寺誠、荒木隆一郎、後藤與四之 ほか、7絶対気圧10分間のヘリウム酸素圧曝露による血管内気泡の出現 日本生気象学会雑誌 Vol.32 (1995) No.3 PS43, doi:10.11227/seikisho1966.32.3_S43
^ 楢木暢雄、富安和徳、31barまでの高圧ヘリウム環境における呼吸放熱による深部体温の低下 The Annals of physiological anthropology Vol.4 (1985) No.2 P147-152, doi:10.2114/ahs1983.4.147
^ Present status of JAEA-Tokai tandem accelerator and booster 原子力機構-東海タンデム加速器の現状 第9回日本加速器学会年会発表資料 (PDF)
^ Kochhar, R. K. (1991年). “French astronomers in India during the 17th - 19th centuries”. Journal of the British Astronomical Association 101 (2): 95–100. http://articles.adsabs.harvard.edu//full/1991JBAA..101...95K/0000100.000.html 2008年7月27日閲覧。.
- ^ abcdClifford A. Hampel (1968). The Encyclopedia of the Chemical Elements. New York: Van Nostrand Reinhold. pp. 256–268. ISBN 0442155980.
^ Sir Norman Lockyer - discovery of the element that he named helium(2009年9月21日時点のアーカイブ)" Balloon Professional Magazine, 07 Aug 2009.
^ “Helium”. Oxford English Dictionary (2008年). 2008年7月20日閲覧。
^ Thomson, W. (1872). Frankland and Lockyer find the yellow prominences to give a very decided bright line not far from D, but hitherto not identified with any terrestrial flame. It seems to indicate a new substance, which they propose to call Helium. Rep. Brit. Assoc. xcix.
^ Stewart, Alfred Walter (2008). Recent Advances in Physical and Inorganic Chemistry. BiblioBazaar, LLC. p. 201. ISBN 0554805138. http://books.google.com/books?id=pIqhPFfDMXwC&pg=PA201.
^ Ramsay, William (1895年). “On a Gas Showing the Spectrum of Helium, the Reputed Cause of D3 , One of the Lines in the Coronal Spectrum. Preliminary Note”. Proceedings of the Royal Society of London 58: 65–67. doi:10.1098/rspl.1895.0006.
^ Ramsay, William (1895年). “Helium, a Gaseous Constituent of Certain Minerals. Part I”. Proceedings of the Royal Society of London 58: 80–89. doi:10.1098/rspl.1895.0010.
^ Ramsay, William (1895年). “Helium, a Gaseous Constituent of Certain Minerals. Part II--”. Proceedings of the Royal Society of London 59: 325–330. doi:10.1098/rspl.1895.0097.
^ Munday, Pat (1999). John A. Garraty and Mark C. Carnes. ed. Biographical entry for W.F. Hillebrand (1853–1925), geochemist and U.S. Bureau of Standards administrator in American National Biography. 10-11. Oxford University Press. pp. 808–9; 227–8.
^ (ドイツ語) Langlet, N. A. (1895年). “Das Atomgewicht des Heliums” (German). Zeitschrift für anorganische Chemie 10 (1): 289–292. doi:10.1002/zaac.18950100130.
^ Weaver, E.R. (1919). “Bibliography of Helium Literature”. Industrial & Engineering Chemistry.
^ van Delft, Dirk (2008年). “Little cup of Helium, big Science” (PDF). Physics today: 36–42. オリジナルの2008年6月25日時点によるアーカイブ。. https://web.archive.org/web/20080625064354/http://www-lorentz.leidenuniv.nl/history/cold/VanDelftHKO_PT.pdf 2008年7月20日閲覧。.
^ “Coldest Cold”. Time Inc.. (1929年6月10日). http://www.time.com/time/magazine/article/0,9171,751945,00.html 2008年7月27日閲覧。
^ Kapitza, P. (1938年). “Viscosity of Liquid Helium below the λ-Point”. Nature 141: 74. doi:10.1038/141074a0.
^ Osheroff, D. D.; Richardson, R. C.; Lee, D. M. (1972年). “Evidence for a New Phase of Solid He3”. Phys. Rev. Lett. 28 (14): 885–888. doi:10.1103/PhysRevLett.28.885.
^ McFarland, D. F. (1903年). “Composition of Gas from a Well at Dexter, Kan”. Transactions of the Kansas Academy of Science 19: 60–62. doi:10.2307/3624173. http://www.jstor.org/stable/3624173 2008年7月22日閲覧。.
^ “The Discovery of Helium in Natural Gas”. American Chemical Society (2004年). 2006年5月20日時点のオリジナル[リンク切れ]よりアーカイブ。2008年7月20日閲覧。
^ Cady, H.P.; McFarland, D. F. (1906年). “Helium in Natural Gas”. Science 24 (611): 344. doi:10.1126/science.24.611.344. PMID 17772798.
^ Cady, H.P.; McFarland, D. F. (1906年). “Helium in Kansas Natural Gas”. Transactions of the Kansas Academy of Science 20: 80–81. doi:10.2307/3624645. オリジナルの2012年5月27日時点によるアーカイブ。. https://archive.is/20120527005227/http://mc1litvip.jstor.org/stable/3624645 2008年7月20日閲覧。.
- ^ abcde小川亮. “ロシアのヘリウム生産の現状と展望” (日本語). 日露技術ニュース. 2010年6月5日閲覧。
^ Emme, Eugene M. comp., ed (1961). “Aeronautics and Astronautics Chronology, 1920–1924”. Aeronautics and Astronautics: An American Chronology of Science and Technology in the Exploration of Space, 1915–1960. Washington, D.C.: NASA. pp. 11–19. http://www.hq.nasa.gov/office/pao/History/Timeline/1920-24.html 2008年7月20日閲覧。.
^ Hilleret, N. (1999). “Leak Detection”. In S. Turner (PDF). CERN Accelerator School, vacuum technology: proceedings: Scanticon Conference Centre, Snekersten, Denmark, 28 May – 3 June 1999. Geneva, Switzerland: CERN. pp. 203–212. http://doc.cern.ch/yellowrep/1999/99-05/p203.pdf. "At the origin of the helium leak detection method was the Manhattan Project and the unprecedented leak-tightness requirements needed by the uranium enrichment plants. The required sensitivity needed for the leak checking led to the choice of a mass spectrometer designed by Dr. A.O.C. Nier tuned on the helium mass."
^ Williamson, John G. (1968年). “Energy for Kansas”. Transactions of the Kansas Academy of Science (Kansas Academy of Science) 71 (4): 432–438. http://www.jstor.org/pss/3627447 2008年7月27日閲覧。.
^ “Conservation Helium Sale” (PDF). Federal Register 70 (193): 58464. (2005年10月6日). http://edocket.access.gpo.gov/2005/pdf/05-20084.pdf 2008年7月20日閲覧。.
^ Stwertka, Albert (1998). Guide to the Elements: Revised Edition. New York; Oxford University Press, p. 24. ISBN 0-19-512708-0
^ “Executive Summary”. nap.edu. 2008年7月20日閲覧。
^ Mullins, P.V.; Goodling, R. M. (1951). Helium. Bureau of Mines / Minerals yearbook 1949. pp. 599–602. http://digicoll.library.wisc.edu/cgi-bin/EcoNatRes/EcoNatRes-idx?type=div&did=ECONATRES.MINYB1949.PVMULLINS&isize=text 2008年7月20日閲覧。.
^ “Helium End User Statistic (PDF)”. U.S. Geological Survey. 2008年7月20日閲覧。
^ Smith, E.M.; Goodwin, T.W.; Schillinger, J. (2003年). “Challenges to the Worldwide Supply of Helium in the Next Decade” (PDF). Advances in Cryogenic Engineering 49 A (710): 119–138. doi:10.1063/1.1774674. https://www.airproducts.com/NR/rdonlyres/E44F8293-1CEE-4D80-86EA-F9815927BE7E/0/ChallengestoHeliumSupply111003.pdf 2008年7月20日閲覧。.
^ Kaplan, Karen H. (2007年6月). “Helium shortage hampers research and industry”. Physics Today (American Institute of Physics) 60 (6): pp. 31–32. doi:10.1063/1.2754594. http://physicstoday.scitation.org/doi/10.1063/1.2754594 2008年7月20日閲覧。
^ Basu, Sourish (2007年10月). “Updates: Into Thin Air”. Scientific American (Scientific American, Inc.) 297 (4): pp. 18. http://www.sciamdigital.com/index.cfm?fa=Products.ViewIssuePreview&ARTICLEID_CHAR=E0D18FB2-3048-8A5E-104115527CB01ADB 2008年8月4日閲覧。
^ サイエンス日本語版2007年12月号
^ 大家 泉、2012、「ヘリウム需給の見通し」 、『高圧力の科学と技術』22巻3号、日本高圧力学会、doi:10.4131/jshpreview.22.185 pp. 185-190
^ 産業ガス最大手の大陽日酸がロシア国営と提携背景にディズニーから風船を奪った世界的ヘリウム不足(2013年4月23日時点のアーカイブ)
^ 深刻 ヘリウム不足 風船販売店は|NHK Bizプラス(2013年4月23日時点のアーカイブ)
^ 東京ディズニーリゾート 【バルーン販売休止のお知らせ】(2013年5月1日時点のアーカイブ)
^ “Qatar’s Helium 2 Plant Officially Inaugurated”. RasGas (2013年12月11日). 2014年11月12日閲覧。
^ 化学工業日報社、「ヘリウム輸入米国品のシェア低下」『化学工業日報』2014年11月12日p1、東京、化学工業日報社。
^ タンザニアに「世界級」のヘリウム田、供給不足を解消も 2016.06.29 Wed posted at 12:09 JST, CNN.co.jp
^ Huge Helium Discovery 'Safeguards Future Supply for MRI Scanners' BusinessNewsline 2016.6.28
^ Emsley, John. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford: Oxford University Press, 2001. Page 178. ISBN 0-19-850340-7
関連項目
- 超流動
- 反ヘリウム
- ヘリウムフラッシュ
- 液体ヘリウム
- 水素爆弾
- 核融合
外部リンク
国際化学物質安全性カード ヘリウム - 国立医薬品食品衛生研究所
周期表 | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | 1 | 2 | | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||||||||||
1 | H | | He | ||||||||||||||||||||||||||||||||||||||||
2 | Li | Be | | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
3 | Na | Mg | | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
4 | K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
5 | Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| |||||||||||||||||||||||||||||||||||||||||||




